La epidemia del SARS-CoV-2), que causa el COVID-19, se ha extendido rápidamente por todo el mundo. España fue uno de los primeros países europeos en verse afectado después de Italia, y se estima que el brote comenzó en febrero de 2020.
La epidemia del SARS-CoV-2), que causa el COVID-19, se ha extendido rápidamente por todo el mundo. España fue uno de los primeros países europeos en verse afectado después de Italia, y se estima que el brote comenzó en febrero de 2020.
A diferencia de los adultos, la enfermedad en los niños parece tener un curso menos severo, sin casi ninguna muerte, y los reportados fueron principalmente en niños con condiciones graves. Pero en abril, algunos niños se presentaron críticamente enfermos con fiebre, shock y signos de inflamación multisistémica, la mayoría de los cuales requirieron ingreso en la unidad de cuidados intensivos pediátricos. Presentaron signos clínicos superpuestos con la enfermedad de Kawasaki que desencadenaron alertas a los pediatras. Tras la alerta, la Organización Mundial de la Salud (OMS), el Centro Europeo para la Prevención y el Control de Enfermedades, los Centros para el Control y la Prevención de Enfermedades de EE. UU y el Royal Collage of Paediatrics and Child Health han elaborado definiciones para esta nueva entidad. Se denominó síndrome inflamatorio multisistémico pediátrico asociado temporalmente con la infección por SARS-CoV-2 (PIMS-TS) o síndrome inflamatorio multisistémico en niños (MIS-C) y se publicó la definición de caso y la orientación sobre el manejo clínico.
La causa de la enfermedad de Kawasaki sigue siendo desconocida; sin embargo, se sugiere que un agente infeccioso podría desencadenar la enfermedad. Una pequeña proporción de pacientes con enfermedad de Kawasaki presenta síndrome de choque por enfermedad de Kawasaki que se asemeja a PIMS-TS / MIS-C . Se informaron casos de enfermedad de Kawasaki con infección concurrente por COVID-19, lo que sugiere que el SARS-CoV-2 puede desencadenar una tormenta de citocinas que conduzca a este síndrome recién definido.
Este estudio tuvo como objetivo comparar la prevalencia y las características de los pacientes con enfermedad de Kawasaki antes de la pandemia de SARS-CoV-2 y compararlos con los casos positivos y negativos de SARS-CoV-2 que se presentaron durante la pandemia.
Durante 2015, se estableció un grupo de estudio de enfermedad de Kawasaki a nivel nacional llamado KAWA-RACE. Los pacientes se incluyeron retrospectivamente desde 2011 hasta 2016 y prospectivamente desde 2018 en adelante, según la declaración de los pediatras de los centros de reclutamiento. Un total de 93 hospitales españoles se incorporaron a la red. La inclusión de pacientes con enfermedad de Kawasaki se aprobó tras el consentimiento informado de los padres / tutores. Todos los datos de los pacientes se anonimizaron completamente antes de acceder a ellos, y luego se revisó la base de datos para limpiar las inconsistencias y confirmar los diagnósticos de los pacientes según la información proporcionada.
Origen, recopilación y gestión de datos
Se incluyeron datos médicos prospectivos desde el 1 de enero de 2018 hasta el 30 de mayo de 2020. Se creó una captura de base de datos electrónica de investigación y se envió a los médicos participantes junto con el protocolo del estudio.
Establecimos la fecha del 1 de marzo de 2020 como casos expuestos al SARS-CoV-2, recolectamos casos hasta el 30 de mayo de 2020 y consideramos este período de COVID-19 (CoV-19p). Se registraron los datos demográficos, clínicos, de laboratorio y ecocardiográficos de los pacientes.
Temas y definiciones de casos
Se revisaron los datos de pacientes individuales para confirmar el diagnóstico de enfermedad de Kawasaki completo o incompleto según la Asociación Estadounidense del Corazón (AHA, 2017). Las mediciones de las arterias coronarias siguieron la puntuación Z de la escala de Montreal y la clasificación según la puntuación Z siguió las directrices de la AHA. Las lesiones de las arterias coronarias (CAL) se consideraron si la puntuación Z> 2 y la disfunción cardíaca si la fracción de eyección era <55%. Se incluyeron en el estudio todos los pacientes <16 años diagnosticados de enfermedad de Kawasaki. Observamos a los pacientes positivos para SARS-CoV-2 para ver si cumplían con la definición de MIS-C de la OMS y / o la definición de PIMS-TS del Royal College of Pediatrics and Child Health.
Se establecieron dos grupos para la comparación. Comparamos los casos de enfermedad de Kawasaki diagnosticados durante el mismo período de 2018 y 2019 (PreCoV) con los de CoV-19p que fueron negativos para el SARS-CoV-2 confirmados tanto por la reacción en cadena de la polimerasa (PCR) como por la serología (CoV-) y durante CoV-19p que fueron SARS-CoV-2 confirmados con PCR y / o serología (CoV +).
Para evaluar la prevalencia, comparamos los mismos períodos de 2018, 2019 y 2020 (del 1 de marzo de 2020 al 30 de mayo de 2020). Se excluyeron los pacientes mayores de 16 años en el momento del diagnóstico, aquellos pacientes diagnosticados del 1 de enero al 29 de febrero de 2020, porque el virus podría estar circulando sin ser detectado, pero no se realizaron pruebas de forma rutinaria y pacientes en los que no se realizó PCR y serología. Por lo tanto, no podemos asegurar que fueran negativos para el SARS-CoV-2.
Resultados
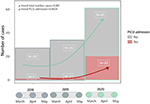
A nivel nacional, se recolectaron 124 casos durante los períodos del 1 de marzo al 30 de mayo de 2018/19/20 y 23 (19%) requirieron la unidad de cuidados intensivos pediátricos; el diagnóstico de enfermedad de Kawasaki se confirmó para todos los pacientes después de la revisión de los datos individuales. Hubo un aumento significativo de casos e ingresos en UCIP en 2020 ( Figura 1 ).
Figura 1 . Tendencia en casos de enfermedad de Kawasaki e ingresos en UCIP del 1 de marzo al 30 de mayo durante 2018-19 (preCoV-19p) y 2020 (CoV-19p).
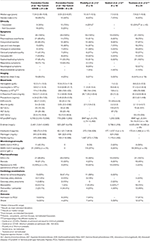
Para la comparación con los grupos CoV– y CoV +, excluimos a 15 pacientes a los que no se les realizó PCR ni serología y, por lo tanto, no pudimos asegurar que fueran negativos para el SARS-CoV-2, dejando 109 pacientes incluidos para análisis adicionales − 63 en el grupo PreCoV , 26 CoV + y 20 CoV–. En el grupo CoV +, la PCR del SARS-CoV-2 fue positiva en el 42% (11/26); La serología del SARS-CoV-2 fue positiva en el 100% (21/21) de los pacientes a los que se realizó la prueba, y ambos fueron positivos en el 29% ( n = 6). A todos los pacientes del grupo CoV- se les realizó una PCR del SARS-CoV-2 y se realizaron serologías que resultaron negativas ( Tablas 1 , 2 ).
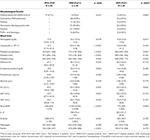
Cuadro 1 . SARS-CoV-2 microbiológico y resultados de análisis de sangre de pacientes con enfermedad de Kawasaki (2018-2019) vs 2020 ( CoV + ) y (CoV-) .
Cuadro 2 . Resultados microbiológicos detallados distintos al SARS-CoV-2 de pacientes con enfermedad de Kawasaki (2018-2019), 2020 (CoV +) y (CoV-).
Características clínicas ( tabla 3 )
La mediana de la edad de PreCoV fue de 2,55 (IQR, 1,5–3,9), 3,56 (IQR, 2,2–6,4) para CoV– y significativamente mayor de 7,54 (IQR, 5,4–10,8) para los pacientes con CoV + ( p <001). Hubo predominio masculino en PreCoV (62%) y en CoV + (69%) con una relación 1: 1 en pacientes CoV-. Encontramos que en los pacientes con PreCoV y CoV–, alrededor de una cuarta parte de ellos eran no caucásicos (18/63, 29% y 5/20, 25%, respectivamente), mientras que en los pacientes con CoV + esto fue significativamente mayor (16 / 26, 64%). La mediana de duración de la fiebre fue de 7 días en todos los grupos.
Cuadro 3 . Características demográficas y clínicas de los pacientes con enfermedad de Kawasaki (2018-2019) frente a 2020 ( CoV + ) y (CoV -).
La enfermedad de Kawasaki completa fue menos frecuente durante el CoV-19p [(CoV– 8/20, 40%) y (CoV + 7/26, 27%) vs. PreCoV (43/63, 68%)]. Es de destacar que durante el CoV-19p, especialmente en el grupo CoV +, hasta el 23% de los pacientes fueron sospechosos y tratados como enfermedad de Kawasaki pero no cumplieron los criterios de la AHA (completos o incompletos), mientras que durante el PreCoV esto no sucedió. Los pacientes de CoV-19p que no cumplieron con los criterios de la AHA cuando se administró el tratamiento, finalmente cumplieron con los criterios de enfermedad de Kawasaki incompleta.
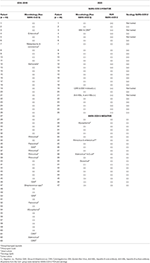
Los pacientes CoV + presentaron significativamente menos cambios en los labios y la boca que los pacientes con PreCoV (85 vs 50%, p <0,005). Ningún paciente del grupo CoV + tuvo piuria estéril, mientras que se observó en el 21% de los pacientes con PreCoV y en el 35% de los pacientes con CoV–. Los síntomas respiratorios no aumentaron durante COV-19p, y aunque era más probable que tuviera una radiografía de tórax anormal en el grupo CoV +, esto no fue significativo. En general, se observaron síntomas gastrointestinales en 57% PreCoV frente a 65% en CoV + y 55% CoV– con una mayor proporción de pacientes con dolor abdominal en el grupo CoV + (33 frente a 58% y 30%). La irritabilidad fue significativamente menor en el grupo CoV +. Se observó un shock que no estaba relacionado con la infusión de IVIG en un mayor número de pacientes durante el CoV-19p (CoV– 4/20, 20% y CoV + 13 / 26,50%, P<0,001) frente al 1,6% de los pacientes durante el PreCoV. Veintitrés (88,5%) de los pacientes CoV + cumplieron los criterios PIMS-TC y MIS-C; de la cohorte CoV–, el 45% de los pacientes cumplieron los criterios para MIS-C y el 40% para PIMS-TS, asumiendo que todos estos pacientes habrían tenido exposición al SARS-CoV-2 durante este período, que no se registra en el base de datos ( Tablas 4A , B ).
TABLA 4A . Pacientes de la cohorte CoV +, indicando KD completo / incompleto y los criterios cumplidos para el diagnóstico de PIMS-TS y MIS-C.
TABLA 4B . Pacientes de la cohorte CoV- que indiquen EK completo / incompleto y que cumplan los criterios para el diagnóstico de PIMS-TS y MIS-C.
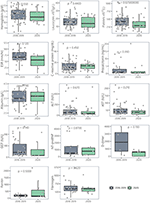
No hubo diferencias significativas en los resultados sanguíneos entre los pacientes con PreCoV y CoV–. Sin embargo, al comparar pacientes con PreCoV y CoV +, encontramos en el grupo CoV + leucocitos significativamente menores (15,5 × 10 9 / L frente a 9,5 × 10 9 / L, p <0,001) y recuento de plaquetas (423 × 10 9 / L frente a 174 × 10 9 / L, p <0,001) y mayor segmento terminal del péptido atrial natriurético (NT-proBNP) (503 pg / ml vs. 4,766 pg / ml, p <0,001), ferritina (185 ng / ml y 476 ng / ml, p <0,001), proteína C reactiva (PCR) (mediana, 10,9 frente a 18,5 mg / dl, p <0,005) y procalcitonina (PCT) (mediana, 0,85 frente a 4,54 ng / ml, p<0,005) ( Tabla 1 , Figuras 2 , 3 ).
Figura 2 . Comparación de los resultados de laboratorio de los casos de enfermedad de Kawasaki (2018-2019) frente a 2020 (CoV +).
Figura 3 . Comparación de los resultados de laboratorio de los casos de enfermedad de Kawasaki (2018-2019) vs. 2020 (CoV-).
Se encontró un hallazgo microbiológico positivo distinto del SARS-CoV-2 en pacientes con PreCoV, CoV + y CoV– en el 27, 15 y 20% de los casos, respectivamente ( tabla 2 ).
Resultado y tratamiento
Los exámenes ecocardiográficos fueron anormales en pacientes con PreCoV, CoV– y CoV + en 37% (23/67), 45% (9/20) y 50% (13/26), respectivamente: CAL se observó en 18/23 (75 %), 3/9 (33,3%) y 4/13 (39%) entre aquellos con ecocardiografía anormal, aneurismas coronarios en 7/63 (11%), 2/20 (10%) y 1/26 (3,8 %), disfunción ventricular izquierda en 1/63 (1,59%), 2/20 (10%) y 8/26 (30,8%) y derrame pericárdico en 13/23 (56,5%), 4/9 (44,4%) ) y 3/13 (23,1%). La disfunción ventricular izquierda fue el único hallazgo ecocardiográfico que fue significativamente mayor en el grupo CoV + que en el grupo PreCoV ( p<0,001) y en todos los casos fue transitorio. No se observaron aneurismas de arterias coronarias gigantes. Se observó una mayor tasa de repolarización anormal en los estudios electrocardiográficos en los pacientes CoV + en comparación con los pacientes PreCoV y CoV– (19 frente a 3% y 0%, respectivamente).
Se administró tratamiento con IgIV al 95, 100 y 80% de los pacientes con PreCoV, CoV– y CoV +, respectivamente. La media de días de aparición de la fiebre tras la administración de IgIV fue de 6 días en todos los grupos. Se administró una segunda dosis de IVIG en el 14% (8/58), 20% (4/20) y 19% (4/21), y se administraron corticosteroides en el 28,6% (18/63), 50% (10 / 20) y 61,5% (16/26), respectivamente. Solo un paciente con CoV + y un paciente con CoV– recibieron Tocilizumab, y un paciente del grupo CoV + recibió Anakinra.
Un número significativamente mayor de pacientes ingresados en la UCIP del CoV + 50% (13/26) frente al grupo de PreCoV 5% (3/63), p <0,001. Al comparar los pacientes con PreCoV y CoV–, todavía hay un número mayor no significativo de pacientes que requieren UCIP 5% (3/63) frente a 30% (6/20). El principal motivo de ingreso en la UCIP en el grupo CoV + fue por disfunción cardíaca o shock. Se proporcionó apoyo vasoactivo a 3/13 (23%) en el grupo CoV + frente a 1/6 (16%) en el grupo CoV– y ninguno durante el PreCoVp.
Sólo un paciente de PreCoV tenía un aneurisma persistente y uno en el CoV– aún está en seguimiento. No se informaron muertes ( Tabla 3 ).
Discusión
Hasta donde sabemos, este es el primer estudio que compara los casos de enfermedad de Kawasaki reclutados prospectivamente que se presentan antes y durante la pandemia y que estudia por separado los casos positivos y negativos confirmados de SARS-CoV-2 y los compara con pacientes prepandémicos de los años anteriores.
Reportamos un aumento significativo en el número de casos de enfermedad de Kawasaki en España durante la pandemia de SARS-CoV-2, con un aumento general de 2 veces en los casos notificados como enfermedad de Kawasaki en la base de datos nacional y un aumento de 10 a 20 veces en los casos ingresados en UCIP en comparación con los 2 años anteriores.
Un estudio similar del norte de Italia encontró una incidencia 30 veces mayor ( 13 ). A pesar de un aumento del doble de los casos notificados como enfermedad de Kawasaki en la base de datos nacional cuando analizamos cada caso en este nuevo contexto, encontramos que la enfermedad de Kawasaki clásica sigue siendo similar, ya que la prevalencia de CoV-EK parece no haber aumentado. Además, nuestra serie proporciona datos que sugieren fuertemente que incluso en la era de COVID-19 permanecen algunos casos de Enfermedad de Kawasaki clásicos y no deben considerarse como PIMS.
La mayoría de los casos confirmados de enfermedad de Kawasaki SARS-CoV-2 cumplieron los criterios PIMS-TC / MIS-C; El conocimiento de la definición de caso tenía la intención de ser sensible y, por lo tanto, se incluyen la mayoría de los casos de enfermedad de Kawasaki. Aunque sea un resultado positivo, la detección del SARS-CoV-2 sugiere PIMS-TS / MIS-C, pero no es esencial para el diagnóstico: un contacto probable con pacientes con COVID-19 es suficiente para PIMS-TS y MIS-C Los criterios incluyen PCR negativa para SARS-CoV-2.
Las características clínicas y de laboratorio de los pacientes con CoV + enfermedad de Kawasaki se asemejan al PIMS-TC / MIS-C y tienen muchas diferencias significativas con los casos de PreCoV. Los pacientes con CoV + EKson mayores, tienen predominio de personas no caucásicas, inflamación más intensa y mayor daño miocárdico que los pacientes con enfermedad de Kawasaki clásica.
Hemos comparado nuestros datos con otras series europeas de enfermedad de Kawasaki que también analizaron los casos de enfermedad de Kawasaki y similares a Kawasaki que se presentaron durante la pandemia. La Tabla 5 resume los datos de Pouletty y cols., Verdoni y cols. y Toubiana y cols.
TABLA 5 . Resumen de la serie sobre la enfermedad de Kawasaki durante la pandemia de SARS-CoV-2.
La mediana de la edad de PreCoV fue de 2,55 años, similar a la del grupo CoV– (3,56 años) y a nuestros datos retrospectivos y significativamente mayor para los pacientes CoV + (7,54 años), que fue más cercana en edad a la informada en el PIMS-TC serie (9 años) y la serie enfermedad de Kawasaki durante la pandemia (7.5-10 año)
Históricamente, se ha sabido que la enfermedad de Kawasaki tiene predominio masculino, y encontramos un predominio masculino en pacientes PreCoV y CoV +. Los afroamericanos se han visto afectados por la pandemia de COVID-19 en una tasa desproporcionadamente más alta.
Curiosamente, encontramos una proporción significativamente mayor de no caucásicos en el grupo CoV +, que no representa a la población general española. Además, nuestro estudio retrospectivo sobre la misma población (2011-2016) encontró que el 76% de los casos de enfermedad de Kawasaki tenían origen europeo. Otros estudios también han encontrado sobrerrepresentación de pacientes no caucásicos en la serie enfermedad de Kawasaki durante la pandemia alcanzando en una cohorte PIMS-TC publicada el 100% de los pacientes, y esto puede sugerir un efecto de ya sea las condiciones sociales y de vida o la susceptibilidad genética.
El grupo CoV + tenía enfermedad de Kawasaki incompleto más probable que en la serie PIMS-TS. Este fenómeno podría deberse a que PIMS-TC y CoV + enfermedad de Kawasaki son una entidad separada o porque los pediatras son más conscientes ahora y diagnostican más enfermedad de Kawasaki incompleta en este contexto. Después de la inyección conjuntival, el síntoma clásico más frecuente fue erupción eritematosa y cambios en los labios y orales significativamente menos frecuentes en pacientes con CoV +; esto también se observó en pacientes con PIMS-TC. Ningún paciente del grupo CoV + tuvo piuria estéril que se observa típicamente en pacientes con enfermedad de Kawasaki clásica.
Los síntomas respiratorios no aumentaron en nuestra serie y, aunque no fueron significativos, fue más probable que se presentara una radiografía de tórax anormal durante la pandemia. Probablemente el pequeño tamaño muestral de nuestra serie no nos permita detectar diferencias significativas. Hubo una mayor proporción de pacientes con dolor abdominal en el grupo CoV +, y este síntoma se observó ampliamente en pacientes con PIMS-TC. La irritabilidad fue significativamente menor en el grupo CoV +, probablemente debido a la mayor mediana de edad en este grupo. Se observó un shock que no estaba relacionado con la infusión de IgIV en un número significativamente mayor de pacientes que eran CoV +. Este fenómeno también fue observado por las otras series de pandemias de enfermedad de Kawasaki ( Tabla 5), probablemente indicando nuevamente que estos pacientes están en el espectro PIMS-TC.
Sorprendentemente, hay una ausencia de casos notificados de MIS similar a Kawasaki asociado con la infección por SARS-CoV-2 en los países asiáticos donde comenzó la pandemia de COVID-19 y donde la incidencia de enfermedad de Kawasaki fue más alta. Se ha planteado la hipótesis de que una mutación de una cepa europea de SARS-CoV-2 impulsa una tormenta de citocinas más fuerte. La serología tuvo más probabilidades de ser positiva que la PCR en nuestra serie, lo que apoya la hipótesis posinfecciosa, porque la enfermedad parece ocurrir 2-4 semanas después de la infección o exposición aguda al SARS-CoV-2. Esto también se ha observado en los pacientes con PIMS-TC y aquellos con insuficiencia cardíaca en este contexto. La familia de los coronavirus podría representar uno de los desencadenantes de la enfermedad de Kawasaki, como se planteó previamente, y el pico de SARS-CoV-2 puede actuar como un superantígeno que impulsa una tormenta de citocinas que conduce a la hiperinflamación. Se encontró un hallazgo microbiológico positivo distinto del SARS-CoV-2 en alrededor del 20-25% de los pacientes con PreCoV y CoV–. Algunos de los pacientes CoV negativos podrían haber tenido un desencadenante diferente a pesar del bloqueo, pero algunos pueden haber sido falsos negativos de CoV que explican por qué este grupo tiene características clínicas y de laboratorio superpuestas. No hubo diferencias significativas en los resultados sanguíneos entre los pacientes con PreCoV y CoV–. Sin embargo, al comparar pacientes con PreCoV con CoV +, encontramos un recuento de leucocitos y plaquetas significativamente más bajo y un NT-proBNP, ferritina, PCR y PCT más altos en los pacientes con CoV + como se encontró en otras cohortes. Estos hallazgos se acercan más a los exhibidos por los pacientes con PIMS-TC / MIS-C y KDSS que a los pacientes con enfermedad de Kawasaki clásica. Los niveles de NT-proBNP que encontramos estaban más en línea con la cohorte Paris Kawa-COVID-19 (mediana 4.319 pg / mL) en contraste con Belhadjer et al. que informaron niveles 10 veces más altos (media 41.484 pg / ml) en pacientes con PIMS-TC.
Los exámenes ecocardiográficos fueron anormales en el 50% de los pacientes con CoV + similares a otras series pandémicas de enfermedad de Kawasaki y superiores a los casos de enfermedad de Kawasaki clásica; esto probablemente se deba a que muchos pacientes con CoV + presentaban disfunción ventricular izquierda.
CAL, definido como Z-score> 2, se observó en un tercio de nuestros pacientes que se presentaron durante la pandemia, pero <10% tenían aneurismas coronarios, y esto fue menos probable en el grupo CoV +. En los pacientes con PIMS-TC, el 7-12% presenta aneurismas. Curiosamente, hay al menos tres estudios que no informan aneurismas coronarios en pacientes con Kawa-COVID-19 y pacientes con PIMS-TC en número absoluto, solo tuvimos un paciente en el grupo CoV + con un aneurisma coronario. Nuestra impresión es que los casos asociados con el SARS-CoV-2, y aunque tienen más compromiso cardíaco, es más probable que sea una disfunción del ventrículo izquierdo que un aneurisma cardíaco, pero esto debe ser estudiado más a fondo.
Se sabe que los niños mayores con enfermedad de Kawasaki e inflamación intensa tienen más probabilidades de presentar miocarditis ( 36 ). Se ha descrito que los niños con PIMS-TC tienen una disfunción cardíaca leve a moderada que indica una lesión miocárdica aguda y que recuperan la función cardíaca normal en una semana, probablemente porque hay inflamación y edema miocárdico pero sin necrosis miocárdica. La disfunción del ventrículo izquierdo fue el único hallazgo ecocardiográfico significativamente mayor en CoV +, y todos los casos fueron transitorios. La repolarización anormal fue relativamente frecuente en los pacientes CoV + en nuestro estudio; esto probablemente esté relacionado con la mayor proporción de pacientes con disfunción ventricular izquierda. Se ha informado de una variedad de anomalías ECG (14 a 60%) en pacientes con PIMS-TC.
Encontramos que si bien el 100% de los pacientes con CoV– recibieron IgIV, esta cifra se reduce al 80% en los pacientes con CoV +. Creemos que esto se debe a que algunos pueden haber sido tratados como PIMS-TC / MIS-C donde algunos médicos administraron esteroides directamente o se recuperaron solo con cuidados de apoyo. Aunque todavía no hay estudios sobre el mejor tratamiento para esta nueva entidad, la mayoría de los grupos están dando tratamiento de primera línea con IGIV seguido de esteroides en algunos pacientes que van del 33 al 64% y agentes biológicos en el 8-14%. Se administró una segunda dosis de IVIG en una proporción similar de pacientes de todos los grupos, y los corticosteroides se administraron con mayor frecuencia en los pacientes con CoV +, probablemente debido a marcadores de inflamación más altos y sospecha de PIMS-TC.
Un número significativamente mayor de pacientes ingresados en la UCIP del grupo CoV +. El motivo de la admisión en la UCIP se debió a una disfunción cardíaca o un shock que se asemeja nuevamente al PIMS-TC en lugar de la enfermedad de Kawasaki clásica. La duración media de la estancia en la UCIP fue por lo general inferior a una semana (4-5 días) . Solo un paciente del PreCoV tenía un aneurisma persistente y uno en el CoV- aún está en seguimiento. No se reportaron muertes.
Nuestro estudio tiene algunas limitaciones potenciales. Existe un posible sesgo de reclutamiento que puede haber contribuido al alto número de pacientes con síndrome inflamatorio multisistémico similar a Kawasaki, ya que los pediatras han estado más conscientes debido a las alertas. Las pruebas de anticuerpos contra el SARS-CoV-2 se realizaron mediante diferentes técnicas según el Hospital; por lo tanto, la sensibilidad y la especificidad tienen un rango amplio, lo que conduce a un posible infradiagnóstico. No pudimos calcular una incidencia general de enfermedad de Kawasaki porque nuestra red no logró una cobertura nacional total. No obstante, pensamos que el número de pacientes recogidos nos permite sacar conclusiones, y el carácter prospectivo de nuestra red KAWA-RACE antes y durante la pandemia nos sitúa en un marco privilegiado para tener una visión general de lo que ha sucedido en España.
En resumen, describimos los hallazgos en el grupo CoV + y destacamos las diferencias clínicas y de laboratorio para clasificarlos como PIMS-TC / MIS-C y no enfermedad de Kawasaki clásica (edad mediana más alta, predisposición no caucásica, presentación más probable incompleta, más disfunción miocárdica, menor desarrollo de aneurismas, más ingresos en UCIP y marcadores inflamatorios más altos).
Aún no se ha dilucidado si se trata de una entidad nueva o de la misma enfermedad en diferentes extremos del espectro. Sin embargo, el SARS-CoV-2 parece ser un desencadenante potente que en algunos pacientes conduce a una respuesta inmune aberrante, especialmente en niños mayores, y puede deberse a infecciones previas.
- 1 Unidad de Enfermedades Infecciosas Pediátricas, Departamento de Pediatría, Hospital Universitario 12 de Octubre, Madrid, España
- 2 Unidad de Investigación y Ensayos Clínicos Pediátricos (UPIC), Instituto de Investigación Sanitaria Hospital 12 de Octubre (imas12), Madrid, España
- 3 Unidad de Enfermedades Infecciosas Pediátricas, Departamento de Pediatría, Hospital Universitario La Paz, Madrid, España
- 4 Departamento de Pediatría, Hospital Universitario Infanta Sofia, Madrid, España
- 5 Servicio de Reumatología Pediátrica, Hospital Sant Joan de Déu, Universitat Autònoma de Barcelona, Barcelona, España
- 6 Departamento de Pediatría, Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, España
- 7 Servicio de Pediatría, Hospital Infantil Universitario Niño Jesús, Madrid, España
- 8 Unidad de Enfermedades Infecciosas Pediátricas, Reumatología e Inmunología, Servicio de Pediatría, Hospital Virgen del Rocío, Sevilla, España
- 9 Departamento de Pediatría, Hospital Universitario Gregorio Marañón, Madrid, España
- 10 Departamento de Pediatría, Hospital Universitario y Politécnico La Fe, Valencia, España
- 11 Unidad de Cardiología Pediátrica, Departamento de Pediatría, Hospital Universitario Vall d’Hebron Barcelona, Barcelona, España
- 12 Unidad de Infecciosas Pediátricas, Departamento de Pediatría, Hospital Universitario Miguel Servet, Zaragoza, España
- 13 Departamento de Pediatría, Hospital Universitario Materno-Infantil de Las Palmas de Gran Canaria, Canarias, España
- 14 Servicio de Pediatría, Hospital Universitario de Donostia, Guipúzcoa, España
- 15 Departamento de Pediatría, Hospital Universitario Puerta Del Mar de Cádiz, Cádiz, España
- 16 Departamento de Pediatría, Hospital Regional Universitario de Málaga, Málaga, España
Fuente : Frontiersin.org
Last Updated on 15 abril, 2021 by Asenkawa